Insulino resistenza, sintomi e rimedi: cos’è e come ridurla?

L’insulina è un ormone indispensabile per il corretto funzionamento del metabolismo energetico e in particolare del metabolismo glucidico. Senza un corretto funzionamento dell’insulina non saremmo assolutamente in grado, ad esempio, di regolare la glicemia e mantenere i livelli di glucosio nel sangue in concentrazioni fisiologiche.
L’insulina è un ormone cosiddetto ipoglicemizzante, cioè ha la funzione di abbassare i livelli di glicemia quando questa è troppo elevata (nello stato postprandiale, cioè dopo aver mangiato). Esplica tale importantissimo controllo agendo principalmente su 3 tessuti: il tessuto muscolo-scheletrico, il tessuto adiposo, e il tessuto epatico.
Nello specifico, per quanto riguarda il metabolismo glucidico, l’insulina aumenta la captazione di glucosio da parte delle fibre muscolari, e ne promuove il suo utilizzo a scopo energetico e il suo utilizzo per ripristinare le scorte di glicogeno, una forma di deposito di energia che troviamo nel tessuto muscolo-scheletrico e nel tessuto epatico.
A livello epatico, l’insulina promuove ancora una volta la sintesi di glicogeno e inibisce la via della gluconeogenesi, ovvero quel percorso metabolico necessario per produrre glucosio de novo. Infine, a livello del tessuto adiposo, l’insulina aumenta la captazione di glucosio e il suo accumulo sotto forma di trigliceridi.
Chiaramente l’insulina ha un ruolo importante anche nel metabolismo proteico e lipidico, in quanto stimola la sintesi proteica muscolare quando vi è disponibilità adeguata di aminoacidi essenziali, e inibisce il catabolismo proteico. Inoltre, blocca la lipolisi, ovvero la mobilizzazione dei grassi, e l’utilizzo di questi a scopo energetico (inibendo la beta-ossidazione). Dunque, nel complesso, l’insulina è un ormone che ha sia un ruolo anabolico sia un ruolo anti-catabolico, in funzione dei tessuti su cui agisce e del contesto metabolico in cui la si osserva.
Che cos’è la resistenza insulinica?
Chiaramente, perché l’insulina possa esplicare tutte queste azioni sui tessuti sopra-menzionati, deve legarsi a specifici recettori (appunto “recettori specifici per l’insulina”) che sono presenti sulla superficie delle cellule dei tessuti. La capacità dell’insulina di “funzionare” quando agisce su un determinato tessuto si chiama “insulino-sensibilità”.
In termini leggermente più tecnici, la sensibilità all’insulina indica la quantità di insulina necessaria per esplicare un’azione, ad esempio permettere l’ingresso di una certa quantità di glucosio in una cellula. Se si è insulino-sensibili è necessario che il pancreas liberi una piccola quantità di insulina per permettere tale azione, se si è resistenti all’insulina, invece, è necessaria molta più insulina per permettere la deposizione della stessa quantità di glucosio.
Un aspetto interessante che è conseguente ai concetti di insulino-sensibilità e insulino-insensibilità dei tessuti, è rappresentato dalla valutazione dei livelli basali di insulina e dalla risposta insulinica in seguito a un evento che perturba l’omeostasi glicemica (ad esempio il consumo di un pasto).
Infatti, se il nostro organismo è insulino-sensibile, allora c’è bisogno di una minor quantità di insulina perché questo ormone esplichi i suoi effetti, e ciò si traduce con livelli basali di insulina nel sangue che sono più bassi (entro un range fisiologico). Viceversa, nel caso di resistenza insulinica, è necessaria una maggiore quantità di insulina per esplicare l’azione, e questo si traduce in livelli di insulina alti e risposte insuliniche al pasto particolarmente elevate: iperinsulinemia.
Dunque, per insulino-resistenza (IR) si intende ogni condizione nella quale una determinata quantità di insulina evoca una risposta biologica alterata (ridotta). Ci sono molti motivi per cui un tessuto può essere resistente all’insulina, ma bene o male i meccanismi eziopatogenetici principali sono i seguenti:
- Difetti nella produzione e secrezione dell’insulina da parte delle cellule β – pancreatiche. Ovvero, potrebbe essere il pancreas a non funzionare bene, o essere l’insulina stessa a essere difettosa.
- Difetti nella ricezione del segnale dell’insulina da parte delle cellule dei tessuti bersaglio (cellule muscolari, adipose, epatiche, e via dicendo).
Che cosa comporta l’insulino-resistenza? Quali sono i sintomi
La resistenza insulinica è una condizione che comporta la necessità di un aumento dei livelli di insulina per esplicare una funzione che, in condizioni sane, avrebbe necessitato di quantità in realtà minori dell’ormone. Più nello specifico, l’insulino-resistenza è una condizione in cui si manifesta una diminuzione della capacità dell’organismo di eliminare una quantità di glucosio dal circolo in risposta all’azione esercitata dall’insulina. Dunque, la resistenza insulinica, comporta:
- Una minor capacità di regolare la glicemia (nello specifico, di abbassare i livelli glicemici in risposta a un pasto che fisiologicamente porta all’innalzamento dei livelli di glucosio nel sangue).
- Un aumento dei livelli basali di insulina e un aumento dei livelli di insulina in risposta a un pasto, quale conseguenza di un tentativo delle beta-cellule pancreatiche di rimediare alla ridotta funzionalità dell’insulina aumentando la quantità secreta dell’ormone.
Chiaramente, quando il trasporto di glucosio stimolato dall’insulina nel muscolo scheletrico e nel tessuto adiposo è ridotto, come avviene nelle persone appunto resistenti all’insulina, con sindrome metabolica o con il diabete di tipo 2, il risultato è l’incapacità di mantenere la glicemia entro valori definiti fisiologici.
Sintomi dell’iperinsulinemia?
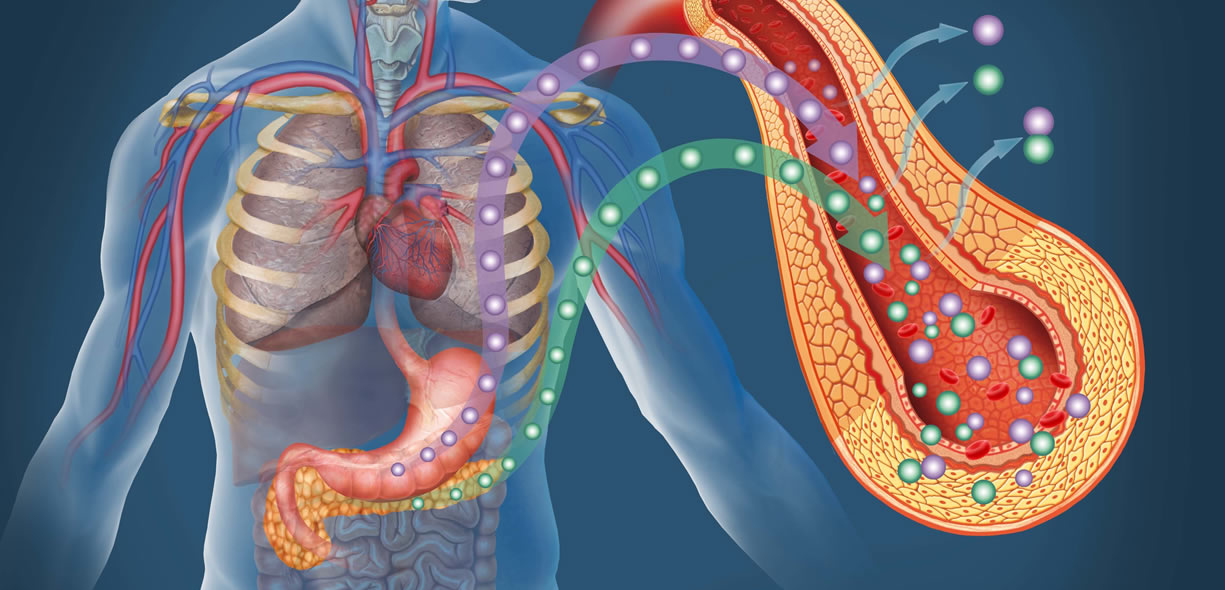
L’iperinsulinemia è una condizione in cui i livelli di insulina sono alterati rispetto ai livelli fisiologici e, nello specifico, sono più elevati. Sulla base di quanto abbiamo detto anche precedentemente, potremmo semplicemente definire l’iperinsulinemia come l’espressione plasmatica della resistenza all’insulina, in quanto l’aumento dei livelli di insulina altro non è che la conseguenza di una ridotta funzionalità dell’insulina – a livelli più bassi – per insulino-resistenza di vari tessuti (es. muscolo scheletrico, tessuto adiposo, fegato).
Che cosa comporta l’insulina alta?
In realtà, l’aumento dei livelli di insulina non ha nessuna particolare conseguenza, in quanto è solo una risposta alla ridotta risposta all’ormone da parte di alcuni tessuti. Pertanto, le condizioni fisio-patologiche e patologiche, e così le eventuali complicanze di tipo metabolico, sarebbero in genere da attribuire alla resistenza all’insulina, all’iperglicemia e al difetto dell’intero metabolismo energetico (l’insulina, come abbiamo visto, agisce sia sul metabolismo glucidico, sia su quello lipidico, sia su quello proteico).
Detto ciò, ci sono alcuni studi che documentano che un eccesso cronico di insulina (cioè che si osserva in soggetti con insulino-resistenza e patologie conseguenti) può aumentare il rischio di sviluppo di alcuni tipi di cancro, in quanto l’insulina è comunque un ormone con azione anabolica che non ha solo funzioni di regolazione del metabolismo energetico.
Un’altra conseguenza che potremmo attribuire all’iperinsulinemia è anche una certa ritenzione idrica. Molti si chiederanno cosa può c’entrare la resistenza all’insulina, e la conseguente iperinsulinemia, con la ritenzione idrica. Il motivo è che l’insulina potrebbe agire anche sul bilancio idro-elettrolitico e così essere implicata sia in conseguenze di tipo “estetico” come la ritenzione idrica, sia in conseguenze più gravi quali ipertensione.
Infatti, la maggior parte dei pazienti con caratteristiche della Sindrome Metabolica ha una pressione sanguigna elevata, e tra i fattori che contribuiscono all’elevazione della pressione vi è anche l’iperinsulinemia, che aumenta il riassorbimento di Na + (sodio) e attiva il sistema nervoso simpatico (che stimola il surrene a lavorare ulteriormente).
Inoltre, il rilascio di fattori proteici dal tessuto adiposo potrebbe stimolare la secrezione di aldosterone indipendentemente dall’angiotensina II, dal K + o dall’ACTH. Ancora, la fonte locale di angiotensina II nel tessuto adiposo può anche essere aumentata in soggetti obesi ipertesi, e ciò suggerisce la partecipazione del sistema renina-angiotensina nella sindrome da insulino-resistenza.
Dunque, alcuni problemi di ritenzione idrica, non sono sempre dovuti a uno squilibrio nell’apporto dietetico di sodio, potassio o acqua, piuttosto da una condizione di resistenza all’insulina e dall’obesità in genere, e dell’iperinsulinemia. Va da sé che per correggere tali alterazioni bisogna focalizzarsi sul migliore la sensibilità all’insulina e quindi “trattare” la condizione di insulino-resistenza.
Quali sono le cause della resistenza insulinica?
Fondamentalmente, la resistenza all’insulina è una marcata riduzione – in certi casi patologica (quando parliamo di “insulino-resistenza patologica”) della sensibilità all’insulina da parte di alcuni tessuti. L’insulino-resistenza sistemica – quella che osserviamo nel soggetto con “pre-diabete” o con diabete, è il risultato finale di una complessa serie di eventi eziopatogenetici che originano dall’insulino-resistenza locale, quindi specifica di un tessuto, che poi ha come conseguenza alterazioni anche negli altri tessuti e poi nell’intero organismo. Ad oggi non è realmente chiaro qual è l’origine dell’insulino-resistenza sistemica, tanto che si studiano principalmente due modelli:
- Resistenza all’insulina epatica > aumento patologico della produzione di glucosio e di grassi > eccesso di glucosio nel sangue di acidi grassi liberi nel sangue (FFA) > infiammazione e deposizione di grasso ectopico > eccesso di grassi (grassi ectopici) a livello muscolare > insulino-resistenza muscolare > incapacità del muscolo di captare glucosio e utilizzarlo a scopo energetico > ulteriore aumento della glicemia e di FFA.
- Insulino-resistenza del tessuto adiposo > incapacità degli adipociti di trattenere e accumulare sempre più grassi > mobilizzazione eccessiva dei grassi (perché la lipolisi non è più inibita dall’insulina) > eccesso di FFA nel sangue > infiammazione e accumulo di grasso ectopico (ad es. nel fegato e nel tessuto muscolare) > il fegato grasso diventa insulino-resistente > il muscolo-scheletrico diventa insulino-resistente > aumento della glicemia e dei trigliceridi.
Descritte, sinteticamente e schematicamente, i meccanismi eziopatogenetici dell’insulino-resistenza patologica, andiamo a vedere, da un punto di vista pratico, quali sono i fattori e le cause dell’insulino-resistenza. Questi fattori possono essere classificati in non modificabili e modificabili.
I fattori non modificabili sono appunto la genetica di base (ci sono anche alcune etnie come quella afro-americana, o gli ispanici, con maggior predisposizione a sindrome metabolica e diabete) e l’età. Infatti, alcuni studi suggeriscono che la sensibilità all’insulina è negativamente associata all’età, ovvero, con l’aumentare dell’età abbiamo una progressiva riduzione della sensibilità dei tessuti all’insulina.
Sebbene in realtà la resistenza all’insulina è molto più correlabile allo stile di vita che all’età in sé (e spesso più si è adulti/anziani più aumenta la probabilità di seguire uno stile di vita più sedentario), possiamo partire dal presupposto realistico che, a parità di condizioni, un soggetto di 65 anni ha una sensibilità all’insulina individuale probabilmente minore di un soggetto di 20 o 35 anni.
Chiaramente l’età è un fattore non modificabile, perché purtroppo (o per fortuna) non possiamo decidere di smettere di far passare gli anni della nostra vita. Tuttavia, un aspetto positivo osservato è che la capacità di invertire la resistenza all’insulina da parte dell’esercizio fisico non sembra essere differente tra giovani e anziani (cioè, è efficace allo stesso modo). Non a caso l’esercizio fisico tende ad essere consigliato agli individui più anziani proprio per migliorare anche il metabolismo glucidico e lipidico.
Per quanto riguarda i fattori modificabili, possiamo sicuramente dire che esiste un’associazione tra obesità e la resistenza all’insulina, con individui insulino-resistenti che di solito hanno più grasso corporeo totale (e soprattutto a livello addominale). Tuttavia, anche questa relazione sembra essere particolarmente influenzata dallo stile di vita generale, poiché gli aumenti della sensibilità all’insulina nei soggetti obesi possono verificarsi anche senza perdita di peso. Quindi, oltre l’obesità, l’altro enorme fattore di rischio è la sedentarietà. Infine, non per importanza, troviamo sicuramente le abitudini dietetiche quotidiane.
Quali sono i sintomi dell’insulino resistenza?
Uno dei motivi per cui la condizione di resistenza all’insulina e, in realtà, anche di sindrome metabolica, è subdola, è che nella maggior parte dei casi è asintomatica. In effetti, un soggetto con IR che ha 120 di glicemia potrebbe non presentare alcun sintomo, esattamente come un soggetto sano con glicemia a 88.
Tuttavia è possibile osservare determinate caratteristiche per ipotizzare un’eventuale insulino-resistenza e quindi riconoscere il paziente a rischio che dovrà poi essere sottoposto a esami diagnostici specifici. In primo luogo, il sovrappeso o l’obesità, soprattutto se addominale, è un segno che potrebbe far pensare all’eventualità della presenza di insulino-resistenza (non è l’obesità a essere la conseguenza dell’IR piuttosto è la causa, attenzione).
Ancora, la presenza di familiarità per sindrome metabolica o diabete, oppure la presenza di altri segni e sindromi di eventuale insulino-resistenza estrema [leprecaunismo, sindrome di Rabson-Mendenhall, Sindrome da insulino-resistenza di tipo A con acanthosis nigricans (una lesione cutanea che spesso viene associata all’insulino-resistenza), lipodistrofie e via dicendo], o la presenza di altre patologie che spesso presentano IR come, nelle donne, la sindrome dell’ovaio policistico (PCOS).
Insulino resistenza e obesità
Come detto più volte, la resistenza all’insulina è più la conseguenza che la causa dell’obesità, in quanto l’infiammazione e la graduale riduzione della sensibilità dei tessuti all’insulina è una conseguenza dell’aumento di grasso corporeo, soprattutto a livello addominale (perché generalmente associato a un aumento del grasso viscerale, che è quello più “infiammatorio”).
Dunque, la convinzione che sia l’insulino-resistenza a causare l’obesità è assolutamente errata, sebbene l’individuo obeso e insulino-resistente sperimenterà, molto probabilmente, una difficoltà maggiore nel perdere successivamente peso e grasso corporeo, e soprattutto nel mantenere il peso che eventualmente, proprio a causa di difetti nel metabolismo energetico che possono essere dovuti all’insulino-resistenza.
Come ridurre la resistenza insulinica ed i suoi sintomi?
L’esercizio fisico è l’intervento elettivo per migliorare l’insulino-resistenza, sia nei soggetti sovrappeso sia nei soggetti. Anzi, alcuni studi notano anche benefici maggiori nella sensibilizzazione all’insulina nei soggetti obesi, probabilmente perché questi soggetti partono da condizioni di base peggiori. Insomma, più è grave una condizione, e più è facile notare un miglioramento effettivo (se, chiaramente, l’intervento è efficace). Quali sono questi interventi efficaci?
L’esercizio fisico, sia di tipo aerobico (ad es. jogging) sia di tipo anaerobico (ad es. sollevamento pesi). Nello specifico, l’esercizio aerobico sembra essere in grado di migliorare acutamente la resistenza all’insulina aumentando l’assorbimento di glucosio nelle cellule. Ad esempio, una sessione di allenamento di 25-60 minuti (al 60-95% della VO2 max), per 3-5 giorni, può causare un “immediato” aumento della sensibilità all’insulina.
Ancora, i miglioramenti, in alcuni studi, si sono visti anche dopo una sola settimana di allenamento aerobico, che consisteva nell’eseguire per lo più 2 sessioni brevi di 25 minuti di camminata al 70% della VO2 max. L’aspetto però interessante e importante da sottolineare è che, purtroppo, è vero anche il contrario: il ritorno allo stile di vita sedentario riduce la sensibilità all’insulina in appena 2 settimane.
Chiariamo che l’esercizio aerobico, eseguito routinariamente, porta cambiamenti benefici nella sensibilità all’insulina anche e soprattutto a lungo termine. E un aspetto importante da sottolineare è che il miglioramento della sensibilità all’insulina a seguito dell’esercizio fisico può verificarsi indipendentemente dalla perdita di peso.
Anche gli esercizi di forza (sollevamento pesi) sono associati ad un aumento della sensibilità all’insulina. Chiaramente l’esercizio anaerobico, esattamente come l’esercizio aerobico, tende ad aumentare la sensibilità all’insulina indipendentemente dal miglioramento della composizione corporea, ma in questo caso l’effetto maggiore lo si ottiene, nel tempo, proprio attraverso l’aumento di massa muscolare – obiettivo primario dell’esercizio con i pesi.
Infatti, poiché il tessuto muscolo-scheletrico è a tutti gli effetti un organo metabolico che contribuisce alla regolazione glicemica (perché fa da “tampone”, aumentando l’assorbimento del glucosio in eccesso e, soprattutto, utilizzandolo quando si fa attività fisica), maggior quantità di massa muscolare abbiamo e maggiore è la sensibilità periferica all’insulina.
Infine, anche la dieta è un fattore modificabile che può essere causa o rimedio per l’insulino-resistenza. Una dieta ipo-normocalorica che abbia delle caratteristiche generali ben precise: aumento di frutta e verdura (aumento principalmente dell’assunzione di fibre e micronutrienti utili per la regolazione glicemica), una riduzione dei grassi saturi e trans e un aumento dei grassi insaturi, un eventuale riequilibrio tra assunzione di grassi omega 6 e omega 3, porta anche all’aumento della sensibilità all’insulina indipendentemente dalla perdita di peso.
Dunque, abbiamo tre macro-fattori che possiamo utilizzare per migliorare la sensibilità all’insulina:
- Perdita di peso
- Esercizio fisico (sia aerobico sia anaerobico)
- Interventi dietetici
Questi sono tutti fattori che, indipendentemente l’uno dall’altro, migliorano la condizione di insulino-resistenza, ma che ovviamente danno il loro meglio quando sfruttati insieme: una riduzione dello stile di vita sedentario prevedendo sessioni di esercizio aerobico routinario anche di soli 20-30 minuti e prevedendo sessioni di allenamento anaerobico (ad es. allenamento con i pesi) per almeno 2-3 sessioni di 50 minuti a settimana, una correzione delle abitudini alimentari. Questi interventi, inoltre, possono probabilmente essere sfruttati per causare anche la perdita di peso (e soprattutto grasso corporeo), e quindi permettere un ulteriore miglioramento della tolleranza ai carboidrati e della regolazione glicemica.
Se ti interessa l’argomento dieta, dimagrimento e ricomposizione corporea, scarica la nostra guida gratuita per cominciare:

Guida di base alla nutrizione
Come mangiare correttamente per dimagrire
Cosa mangiare in caso di insulino resistenza?
In effetti, un soggetto insulino-resistente non ha nessun motivo valido, dal punto di vista scientifico, per abolire dalla propria dieta alcun tipo di cibo, al netto degli alimenti ultra-lavorati che dovrebbero invece essere consumati in maniera minima – o per niente – dall’intera popolazione in generale e non solo per i soggetti insulino-resistenti.
Quello che però possiamo dire è che sicuramente ci potrebbero essere abitudini alimentari e interventi dietetici che possono assecondare la condizione fisio-patologica del soggetto insulino-resistente, evitando di andare a forzare un sistema di regolazione dell’omeostasi che è invece difettoso. Nello specifico, dunque, è bene intervenire aumentando l’apporto di fibre, che si possono ottenere consumando una maggior quantità di alimenti integrali, legumi, verdure e frutta poco zuccherina, quando possibile con la buccia.
Ancora, evitare pasti e diete troppo abbondanti in carboidrati, in quanto i soggetti insulino-resistenti sono meno in grado di tollerare i glucidi e di mantenere i livelli fisiologici di glicemia postprandiale. Questo non significa dover seguire necessariamente diete low carb o chetogeniche, ma semplicemente tener presente che un minor carico glicemico dell’intera dieta può aiutare a rendere meno evidente la condizione di insulino-resistenza.
Resistenza insulinica e dimagrimento: come dimagrire se si ha l’insulino resistenza?
Se si è sovrappeso/obesi e si è insulino-resistenti è necessario ottenere una perdita di peso, graduale, andando ad agire su due aspetti:
- Miglioramento della sensibilità all’insulina e utilizzo di modelli alimentari che non mettono a dura prova il metabolismo glucidico che è difettoso.
- Lo stile di vita attivo e l’attività fisica anche strutturata, possibilmente mista, cioè in parte aerobica in parte anaerobica, che è di fondamentale importanza.
Dieta dimagrante per l’insulino resistenza

Ad oggi, la letteratura scientifica documenta, attraverso moltissimi studi controllati con risultati coerenti tra loro, che non esiste, in assoluto, una dieta migliore per la perdita di peso. Questo vale per soggetti obesi che vogliono perdere peso e, in linea di massima, anche per i soggetti insulino-resistenti.
Le diete low carb e le diete chetogeniche potrebbero avere dei leggeri vantaggi metabolici per la perdita di peso nei soggetti con diabete o con insulino-resistenza. Tuttavia, soprattutto la dieta chetogenica, può presentare degli effetti collaterali in questi soggetti, e quindi necessita che il paziente sia sotto monitoraggio e che gli effetti vengano valutati più volte nel corso del trattamento.
Ad ogni modo deve essere chiaro che, come documentano anche le meta-analisi più recenti sull’argomento, la perdita di peso e grasso corporeo è dovuta sempre alla restrizione energetica, e questo è il caso anche delle diete low carb o chetogeniche, che in molti studi mostrano perdite di peso simili rispetto ad altri tipi di diete ipocaloriche nei soggetti insulino-resistenti.
Una volta imposto un deficit calorico adeguato, e una volta che ci si è assicurati un apporto proteico ottimale per il mantenimento della massa muscolare (o in alcuni casi per la ricomposizione corporea – nel caso di soggetti ipoallenati, con sarcopenia, che seguivano diete ipoproteiche, e che iniziano ad allenarsi con i pesi), la proporzione tra grassi e carboidrati non è così fondamentale.
Dunque, la conclusione deve essere che esistono veramente molti modi, molte strategie e molti modelli alimentari per indurre la perdita di peso, anche nei soggetti insulino-resistenti, e che non bisognerebbe fossilizzarsi su un’ottimale distribuzione dei macronutrienti (che al momento non è conosciuta, se mai esistesse un’ottimale distribuzione dei macronutrienti per questi soggetti) ma piuttosto nel seguire semplici e corrette abitudini alimentari e tenere a mente l’importanza delle dosi (quindi degli aspetti quantitativi della dieta) e delle fonti (da preferire alimenti poco densi energeticamente e alimenti più ricchi in fibre).
Insulino resistenza e integratori
Sono tantissime le sostanze e gli integratori che, nel tempo, sono state proposte come efficaci per migliorare la sensibilità all’insulina e quindi per ridurre i livelli insulinici e glicemici. Tuttavia, la maggior parte di questi ha in realtà uno scarso o nullo effetto, e solo poche eccezioni possono essere realmente interessanti secondo un giudizio evidence based.
Il cromo, ad esempio, è spesso utilizzato per ridurre la resistenza all’insulina, tuttavia, quando è integrato da persone con livelli di cromo normali o elevati, non si ottiene alcun effetto affidabile. Discorso diverso quando vi è una carenza subclinica o conclamata. Stesso identico destino per il magnesio, che nonostante venga spesso promosso come vera e propria panacea per il miglioramento della glicemia e della sensibilità all’insulina, ha un (limitato) effetto solo nei soggetti carenti.
Si tenga conto, però, che poiché i cereali non sono in realtà una buone fonte di magnesio, e quest’ultimo lo si ritrova principalmente nella frutta secca e in alcune verdure, che non vengono consumate spesso nella dieta tipica occidentale, una buona percentuale di persone è in realtà carente di magnesio (molte sono anche inconsapevoli di esserlo).
Gli omega 3 e l’integrazione di olio di pesce non sembra, contrariamente a quanti molti pensano, migliorare significativamente la sensibilità all’insulina e migliorare, quindi, la glicemia. Sebbene gli omega 3 siano sostanze con conclamate azioni anti-infiammatorie, con effetti benefici riguardanti il profilo lipidico, non sono osservate differenze significative né di riduzione della glicemia né di riduzione degli eventi e/o della mortalità per eventi cardiovascolari, con la loro integrazione.
Un altro integratore inutilmente mitizzato è la curcumina, il principale principio attivo della curcuma, che seppur è una sostanza con conclamate azioni anti-infiammatorie, e sembra poter essere utile per ridurre (lievemente) i sintomi di ansia e depressione, ha poche evidenze a supporto di un suo eventuale effetto di riduzione della glicemia e di miglioramento del profilo lipidico.
Al contrario, un integratore un po’ più interessante è la berberina, un alcaloide estratto da alcune piante, che grazie alla sua capacità di attivare AMPK, sembra avere un effetto di riduzione della glicemia. Studi recenti hanno dimostrato che 1500 mg di berberina, assunti in 3 dosi da 500 mg ciascuna, può avere ottimi effetti di riduzione della glicemia (addirittura simili a 1500 mg di metformina, anche se vanno condotti ulteriori studi per valutare tali effetti benefici e soprattutto la sicurezza e gli effetti collaterali a medio-lungo termine).
Infine, un integratore interessante è l’inositolo, che ha mostrato buone evidenze per il trattamento dell’intero spettro di sintomi della sindrome dell’ovaio policistico (che è una sindrome con IR associata); nello specifico, dosi elevate (da 3.000 a 4.000 mg) sembrano essere più efficaci nel migliorare la sensibilità all’insulina. Tocca tuttavia specificare che questi effetti benefici dell’inositolo sono studiati principalmente nelle donne con PCOS e non in altre popolazioni caratterizzate da insulino-resistenza.
Quali analisi e quali esami fare per diagnosticare e scoprire la resistenza insulinica?
Generalmente, nello screening di base si va sempre a valutare la glicemia a digiuno e il profilo lipidico (trigliceridi, colesterolo totale, C-HDL e C-LDL). In genere si parla di “pre-diabete” (negli ultimi anni l’espressione di prediabete è stata abolita e sostituita con “alterata glicemia a digiuno” per valori di glicemia a digiuno di 100/110-125 mg/dl.
Se un soggetto presenta tali valori, abbinati a un profilo lipidico alterato, con altri segni e fattori di rischio per la sindrome metabolica/diabete, come l’obesità (soprattutto addominale) e la familiarità per il diabete, allora potrebbe essere il caso di richiedere un test di tolleranza al glucosio, che è utile per valutare la risposta all’innalzamento del glucosio (si misura la glicemia ad intervalli di tempo prestabiliti dopo un’importante somministrazione di glucosio in forma liquida).
Tuttavia, se vogliamo valutare realmente l’insulino-resistenza, non dobbiamo fossilizzarci solo sulla misurazione della glicemia e sulla curva glicemia, ma ci potrebbe essere d’aiuto andare a guardare proprio anche i valori di insulinemia. Infatti, ricordo a tutti che nei casi di insulino-resistenza la glicemia può comunque rientrare nei livelli fisiologici, ma questo necessiterà di livelli di insulina maggiori della norma. Dunque, è stato elaborato un indice (Indice HOMA, Homeostatic Model Assessment) che è basato sulla misurazione dei livelli non solo di glucosio ma anche di insulina. La formula per l’indice HOMA è la seguente:
Indice HOMA = (glicemia x insulinemia) / 22.5 (dove la glicemia è espressa in mmol/L e l’insulina in mU/L). Valori < 2.5 si traducono in un’assenza di insulino-resistenza, mentre valori > 2.5 indicano la presenza di insulino-resistenza.
Conclusioni sulla resistenza insulinica
Al termine di questo articolo devono apparire chiari determinati concetti:
- la resistenza insulinica è una condizione che si manifesta per opera di molteplici fattori integrati tra loro in seguito all’eccessivo aumento di grasso corporeo, soprattutto se l’accumulo è a carico principalmente dei depositi viscerali.
- L’iperinsulinemia che osserviamo nei soggetti con IR è, nella maggior parte dei casi, un adattamento che per certi versi è protettivo, da parte del pancreas (compensazione pancreatica alla resistenza all’insulina), per ottenere la regolazione glicemica (riduzione della glicemia)
- Non sempre sono presenti sintomi che possono suggerire la presenza di insulino-resistenza, ed è per questo importante fare check up di base con frequenza almeno annuale, e nel caso si osservi una glicemia o un profilo lipidico alterato, procedere con analisi più specifiche come il test OGTT e l’esame dell’emoglobina glicata.
- L’insulino-resistenza è una conseguenza dell’obesità e non una causa. Tuttavia, un soggetto obeso insulino-resistente potrebbe sperimentare una difficoltà maggiore nel seguire un percorso di dimagrimento.
Da un punto di vista puramente pratico, per dimagrire e migliorare l’insulino-resistenza, è importante sintonizzarsi con una forma mentis che prevede almeno 3 step: 1) miglioramento dell’IR a prescindere dal miglioramento della composizione corporea; 2) miglioramento della composizione corporea con perdita di grasso e aumento di muscolo; 3) mantenimento della forma fisica raggiunta grazie al mantenimento delle buone abitudini alimentari e di stile di vita generale.
Il primo passo da fare è migliorare la resistenza all’insulina, sia nel breve che nel lungo periodo, aumentando i livelli di attività fisica (quindi avere uno stile di vita attivo) e prevedere almeno 3 sessioni di esercizio fisico strutturato a settimana, preferibilmente che consista in almeno 2 sessioni di allenamento con i pesi.
Inoltre, è fondamentale instaurare un deficit energetico (dieta ipocalorica) ricorrendo a interventi dietetici che siano mirati all’ottimizzazione della compliance e dell’aderenza alla dieta. Ciò è di vitale importanza in quanto, ad oggi, non è stata trovata una dieta migliore rispetto a un’altra, per il dimagrimento e la riduzione della resistenza all’insulina, a parità di apporto calorico e apporto proteico.
La raccomandazione generale è di creare un deficit calorico giornaliero di circa 500 kcal (si possono seguire protocolli nutrizionali di diverso tipo che prevedono una normocalorica in alcuni giorni e un’ipocalorica più marcata in altri, con il risultato di un deficit calorico complessivo di circa 3500 kcal settimanali).
Proprio in merito all’apporto proteico, per chi ha un’assunzione proteica inferiore a 1,2 g per kg di peso corporeo, è bene che aumenti l’apporto proteico (fino ad anche 1,6 g/kg) per preservare o aumentare la massa muscolare. Un aumento del tessuto muscolare causerà benefici sia estetici, sia nella qualità della vita (miglior funzionalità fisica), sia dal punto di vista metabolico (miglior salute). Preferibilmente utilizzare fonti proteiche vegetali o fonti animali prevalentemente magre.
Infine, per soggetti che hanno difficoltà a gestire quantità elevate di glucidi (cosa probabile, nei soggetti con IR), può essere maggiormente efficace una dieta a basso contenuto di carboidrati (che preveda comunque l’assunzione di verdure e alimenti ricchi in fibre, come potrebbero essere i legumi, alcuni frutti, e piccole quantità di cereali integrali). Questa raccomandazione è valida ed efficace solo se tale tipo di dieta risulti attraente e fattibile dal soggetto in questione.
Se ti interessa l’argomento dieta, dimagrimento e ricomposizione corporea, scarica la nostra guida gratuita per cominciare:

Guida di base alla nutrizione
Come mangiare correttamente per dimagrire
Autore articolo – Daniele Esposito

Daniele Esposito, classe 91, laureato in Scienze Motorie e in Scienze della Nutrizione umana. Appassionato di fisiologia e fisiopatologia in relazione all’alimentazione umana. Si occupa di nutrizione a 360°, sia in ambito clinico sia in ambito sportivo. Autore e divulgatore scientifico, autore di Project Diet Vol.1-2 e co-direttore, revisore e co-autore della rivista Project Magazine.