Insulina: funzione, valori e diabete

L’insulina è un ormone peptidico di 51 amminoacidi, secreto dal pancreas endocrino principalmente in risposta all’assunzione di cibo, ha un effetto ipoglicemizzante, anoressizzante e generalmente anabolico su molti tessuti.
Spesso viene accusata di essere la causa dell’obesità, del diabete mellito di tipo 2 e virtualmente qualsiasi altro problema di salute, tuttavia come vedremo la realtà scientifica è ben distante da queste affermazioni.
Cos’è l’insulina e chi la produce ?
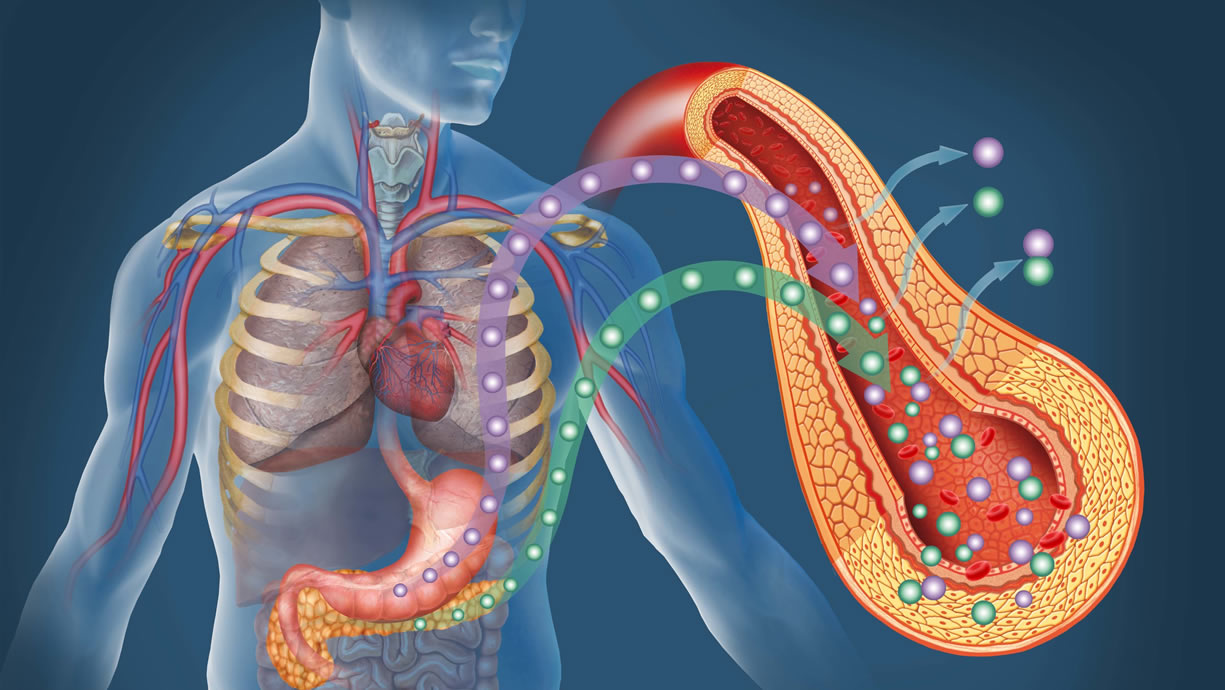
L’insulina è prodotta nelle cellule Beta delle Isole di Langherans pancreatiche, è inizialmente sintetizzata assieme ad una catena peptidica inattiva, il peptide C.
Nel complesso (peptide C + insulina) è chiamata pro-insulina, nel momento in cui viene internalizzata nelle vescicole secretorie, è quasi totalmente idrolizzata in insulina e peptide C in uguali quantità.
La secrezione di insulina è sia basale che stimolata ai pasti, nel particolare il glucosio è molto efficace nello stimolarne la secrezione, seguito da amminoacidi (specie Leucina, Arginina) e acidi grassi (indirettamente, attraverso l’azione dell’adipochina ASP).
Altri fattori endocrini possono potenziare la secrezione insulinica, ad esempio: GIP, GLP-1, CCK (ormoni gastroenterici secreti al pasto) e la stimolazione Beta-adrenergica (adrenalina).
Nel pancreas umano, il glucosio entra principalmente attraverso i GLUT-1 e GLUT-3, trasportatori ad elevata affinità (a differenza del fegato umano o del pancreas murino, che invece esprimono più il GLUT-2 a bassa affinità) così che fungano da “sensori” cellulari dei livelli di glucosio ematico, in pratica la concentrazione cellulare è in equilibrio con quella ematica.
Il glucosio entrando nel citosol stimola la glicolisi, aumenta velocemente il rapporto ATP/ADP cellulare che attiva la pompa Na+/K+, si depolarizza quindi la cellula che causa l’apertura dei canali voltaggio dipendenti del Calcio e si ha la secrezione delle vescicole di insulina.
Recettori dell’insulina
I recettori dell’insulina appartengono alla famiglia dei recettori tirosin-chinasici, generalmente bersaglio di fattori di crescita, come l’IGF-1.
Nel caso del recettore insulinico vi è una particolarità: infatti l’insulina ha sia effetti mitogeni (crescita e differenziamento cellulare) che metabolici. Il recettore presenta due subunità, Alfa e Beta, la prima è extracellulare e si lega all’insulina, la seconda attraversa la membrana cellulare e si autofosforila in seguito al legame con l’insulina.
In seguito a stati fisiologici (digiuno, chetosi) e patologici (diabete mellito di tipo 2) si ha un’alterata segnalazione insulinica, che può avvenire per sottoregolazione del numero di recettori in risposta ad un più elevato livello basale di insulina o per meccanismi trasduzionali (quindi a livello post-recettoriale) mediato ad esempio dai chetoni o dagli acidi grassi liberi.
A cosa serve l’insulina ?
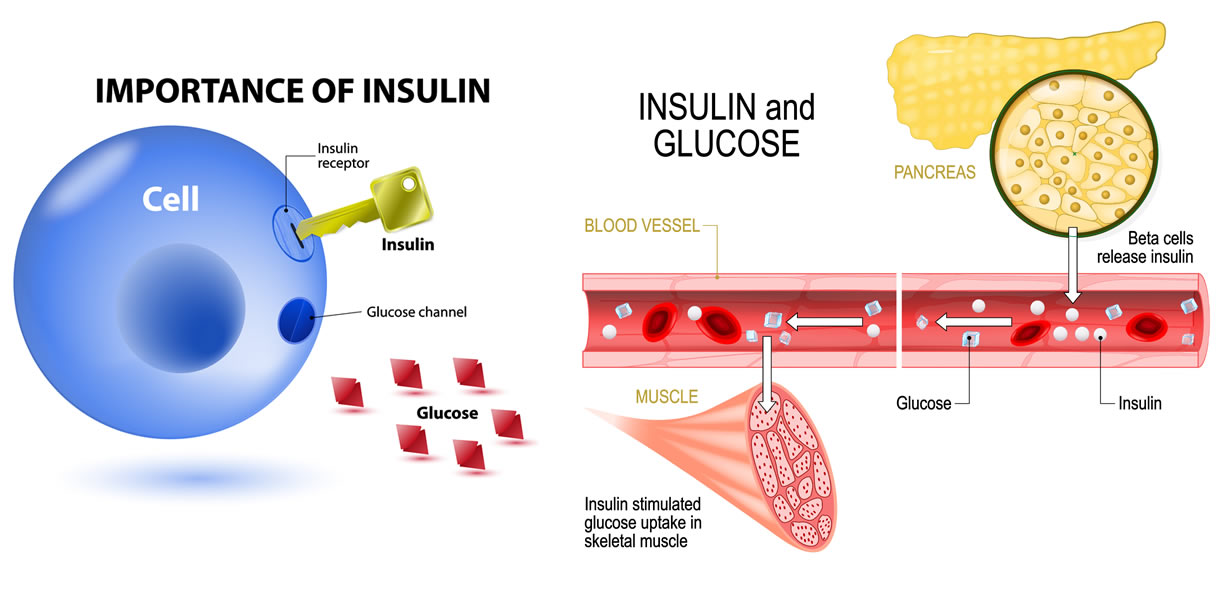
Uno dei principali mediatori dell’insulina sui tessuti insulino-sensibili (adipocita, muscolo) è il GLUT-4, un trasportatore di glucosio che subisce esocitosi a livello della membrana cellulare in seguito all’azione dell’insulina, ha un’elevata affinità col glucosio e ne permette un rapido ingresso nella cellula.
L’insulina ha effetti su molti tessuti e organi, i più importanti nell’adulto sono: fegato, tessuto adiposo e tessuto muscolare (fibrocellula).
Fegato
- Sintesi del glicogeno e inibizione della sua degradazione
- Sintesi di proteine, riduzione della gluconeogenesi e chetogenesi da amminoacidi
- Stimolo sulla glicolisi e tutti i processi di utilizzo del glucosio
- Sintesi di trigliceridi e lipoproteine VLDL
Tessuto adiposo
- Inibizione della lipolisi intracellulare
- Stimolo della lipasi di membrana (LPL) che idrolizza i trigliceridi ematici permettendone l’uptake
- Aumento dell’uptake di glucosio (GLUT-4) e sintesi del glicerolo fosfato
- Sintesi di trigliceridi
Muscolo
- Aumento dell’uptake di amminoacidi
- Aumento dell’uptake di glucosio (GLUT-4) e sintesi di glicogeno
- Aumento dei processi di utilizzo del glucosio e inibizione dell’ossidazione di acidi grassi
- Riduzione della proteolisi
- Aumento della sintesi proteica (massimizzata già a concentrazioni basali, altrimenti avviene solo a dosi sovrafisiologiche)
L’insulina ha anche importanti ruoli genomici, infatti è necessaria per mantenere espressi sulle membrane cellulari i trasportatori di glucosio GLUT-1 e GLUT-3. Nel Diabete mellito di tipo 1 non trattato con insulina si ha forte carenza di questi trasportatori, motivo per il quale anche i tessuti non insulino sensibili (quindi tutti quei tessuti che non sono muscolo e grasso) soffrono della carenza di insulina e impediscono lo sviluppo.
Alcune considerazioni sul metabolismo del tessuto adiposo e muscolare in risposta all’insulina
L’insulina ha effetti acuti di lipogenesi nel tessuto adiposo, quindi sì fa ingrassare, ma questo processo è acuto e non avviene solo per l’insulina; infatti l’insulina è secreta ai pasti, e il cibo fornisce macronutrienti che saranno quindi metabolizzati di conseguenza.
- In un pasto prevalentemente lipidico sarà meno stimolata in acuto l’insulina, ma sarà anche ridotto l’utilizzo del glucosio da parte di tutti i tessuti, inoltre i grassi non spariscono dal sangue per magia ma vengono esterificati molto facilmente anche con poca insulina grazie anche all’azione diretta e indiretta dell’ASP (adipochina secreta ai pasti lipidici che ha la funzione di depositare gli acidi grassi nel tessuto adiposo).
- Viceversa, in pasto molto glucidico sarà ridotto l’uso dei grassi e quindi si avrà maggior conservazione dei trigliceridi dell’adipocita e le altre cellule sposteranno il metabolismo verso l’utilizzo del glucosio.
Questi processi sono conosciuti e studiati da molto tempo, un celebre studioso è il biochimico Phillip Randle in onore del quale (nel 1963) è stato coniato il termine “Ciclo di Randle” in riferimento alla regolazione coordinata del metabolismo di glucosio e acidi grassi.
Questo significa che il bilancio calorico è determinante dell’aumento o della riduzione del peso, indipendentemente dalla secrezione di insulina (è stato ampiamente dimostrato anche da studi sull’uomo metodologicamente eccellenti, dai gruppi di K.D. Hall e C.D.Gardner). Per comprenderlo dobbiamo capire che se nel breve termine bruciare grassi sembra voler dire dimagrire, nella realtà (nel cronico) per perdere grasso dobbiamo abbassare i livelli energetici delle cellule.
Bruciare più grassi ma avere ancora la stessa energia nelle cellule vuol dire che da una parte stiamo ossidando i grassi ma dall’altra gli stiamo accumulando. Pensate ad una vasca da bagno, mangiare meno carboidrati e più grassi fa si che l’organismo faccia uscire più lipidi ma nello stesso tempo ne sta accumulando di più. È il bilancio calorico che determina se ingrassiamo o dimagriamo, non il bruciare più o meno grassi!
Nel muscolo scheletrico invece, l’insulina ha un ruolo facilitatore e coadiuvante nella sintesi proteica; si è visto infatti che nelle persone sane gli effetti dell’iperinsulinemia senza la concomitante iperaminoacidemia (cioè somministrando solo insulina) non aumenta la sintesi proteica in quanto si ha ipoamminoacidemia, invece quando avviene fisiologicamente (pasto proteico) la aumenta; tuttavia questo è un classico effetto dell’iperamminoacidemia che avviene anche nei modelli sperimentali di diabete di tipo 1 (insulino-dipendente).
Il ruolo “facilitatore” è dato dal fatto che l’insulina aumenta la sintesi di ossido nitrico (NO) un vasodilatatore, permettendo quindi un maggior afflusso di sangue e nutrienti ai tessuti.
Più interessante invece l’effetto anticatabolico, che è rilevante ed è indotto indipendentemente dalla presenza di amminoacidi (quindi anche con soli carbodirati), probabilmente inducendo l’utilizzo preferenziale di glucosio a scopo energetico, riducendo la formazione di vacuoli autofagici e aumentando il trasporto di amminoacidi.
Insulino resistenza, diabete mellito di tipo 1 e 2
Probabilmente la prima associazione mentale che avviene con la parola insulina è diabete, e non a caso: in entrambi i tipi di diabete si hanno disfunzioni nel metabolismo del glucosio.
Il diabete di tipo 1 è caratterizzato da perdita della funzione di secrezione dell’insulina, causato da aggressione autoimmune alle Beta cellule (la più frequente) e distruzione delle stesse o da cause idiopatiche o iatrogene (ad esempio pancreasectomia totale).
L’esordio è tipicamente precoce, prima dell’età adulta, anche se esistono forme autoimmune tipiche degli adulti come il LADA, che ha un esordio meno brusco della forma classica.
Spesso all’esordio si possono notare dei marcatori ematici tipici dell’autoimmunità specifica ad esempio anticorpi anti GAD, anti insulina (IAA), anti IA-2 o anti isole (ICA).
La terapia medica è la terapia sostitutiva con analoghi sintetici dell’insulina umana o insuline a farmacocinetica modificata come le rapide, intermedie e basali. Viene somministrata ai pasti in dose in base al contenuto glucidico, il fattore di sensibilità e il target glicemico del paziente.
Il diabete di tipo 2 invece, di gran lunga più diffuso è caratterizzato da un quadro variabile di resistenza all’insulina e deficit secretorio relativo di insulina.
La maggior parte dei diabetici di tipo 2, specialmente in Europa e Stati Uniti è obeso (60-80% dei diabetici di tipo 2) con prevalenza di obesità addominale, in questi casi si verifica resistenza insulinica periferica (grasso e muscolo metabolizzano meno glucosio del normale in risposta all’insulina) ma anche a livello del fegato (non viene soppressa adeguatamente la gluconeogenesi).
Questa situazione inzialmente è compensata da aumentata secrezione di insulina da parte del pancreas, ma se non tratta dal punto di vista medico e dietetico, porta ad una progressiva perdita della funzione delle cellule Beta del pancreas: il glucosio in eccesso “usura” tutte le componenti proteiche (fenomeni di glicazione) e i livelli più alti di acidi grassi liberi (il tessuto adiposo continua a fare lipolisi anche con insulina elevata) causano stress al reticolo endoplasmatico producendo fenomeni di lipotossicità.
C’è sicuramente una componente genetica eterogenea nella predisposizione al diabete di tipo 2, ma è anche vero che il sovrappeso e l’obesità alimentano questa malattia: la perdita di peso e l’attività fisica sono in grado di prevenire e curare il diabete di tipo 2, qualora sia dato da prevalente insulino-resistenza.
Infatti il farmaco più usato (e con successo) è la Metformina, che sembra agire mimando gli effetti dell’AMPK e quindi dell’attività fisica e della restrizione calorica… agisce infatti da inibitore della catena respiratoria riducendo l’efficienza della sintesi di ATP e la produzione di radicali liberi.
Il diabete di tipo 2 e di tipo 1 non compensati portano ad aumentati rischi per numerose malattie e cause di morte tra cui: micro e macroangiopatie quindi malattie coronariche e infarto, ictus, insufficienza renale, retinopatia e cecità, neuropatie periferiche, complicanze ortopediche, e in particolare per il tipo 2 malattie epatiche (NAFLD e NASH), alcuni tumori.
| Diabete Tipo 1 | Diabete tipo 2 | |
| Prevalenza nella popolazione | 0,3% | 5% |
| Sintomatologia | Spesso presente e con brusco esordio | Spesso assente e modesta |
| Tendenza alla chetosi | Presente | Assente |
| Peso corporeo | Normale o ridotto | Spesso eccesso di peso |
| Età di esordio | In genere <30 anni | In genere >40 anni |
| Complicanze croniche | Spesso assenti alla diagnosi | Spesso già presenti |
| Livelli di insulina | Bassa o assente | Normale o aumentata |
| Autoimmunità alla diagonsi | Presente | Assente |
| Terapia | Necessaria insulina | Dieta, attività fisica, ipoglicemizzanti orali, agonisti GLP-1, insulina |
Se ti interessa l’argomento dieta, dimagrimento e ricomposizione corporea, scarica la nostra guida gratuita per cominciare:

Guida di base alla nutrizione
Come mangiare correttamente per dimagrire
Insulina e glucagone
Il glucagone è un altro ormone pancreatico, ha un ruolo controregolatore sul metabolismo glucidico rispetto all’insulina:
- stimola la gluconeogenesi epatica
- stimola la glicogenolisi epatica e l’aumento della glicemia
- inibisce la glicolisi epatica
- inibisce la sintesi di trigliceridi e stimola la chetogenesi
La secrezione stessa di insulina sembra inibire le cellule Alfa delle isole di Langherans che secernono glucagone, mentre è stimolato il suo rilascio dagli amminoacidi.
In pratica un pasto proteico è un potente stimolatore del glucagone (ma anche dell’insulina), così come lo è il digiuno e una dieta chetogena (nel medio-breve termine).
Il glucagone ha un effetto lipolitico sul tessuto adiposo umano in vitro, tuttavia in vivo questo effetto è probabilmente poco rilevante perchè la sua secrezione fisiologicamente è accompagnata da insulina e GIP, che inibiscono la lipolisi (pasto misto/proteico) o dal digiuno, dove è sinergico con gli altri ormoni controinsulari.
Questo per dire che il rapporto insulina/glucagone, preso come target “terapeutico” nella dieta a Zona è in realtà abbastanza fuorviante, perchè in vivo gli effetti lipolitici del glucagone ad un pasto sono inesistenti in quanto antagonizzati dall’insulina.
La gluconeogenesi promossa dal glucagone agisce a livello epatico ma non a livello muscolare, infatti non ha alcun effetto sulla proteolisi muscolare a differenza del cortisolo.
Insulina e Valori ed esami del sangue
Nell’uomo la secrezione totale nelle 24h di insulina è di circa 30 UI, a digiuno si hanno valori basali tra 5-10 microUI/mL o comunque inferiori a 25 microUI/mL che possono aumentare anche di 10-20 volte i livelli basali in risposta ad un pasto.
L’insulina è misurata a digiuno per indagare un modello “statico” di omeostasi del glucosio, come screening per il diabete mellito o insulino-resisitenza, allo scopo ci si avvale anche dei valori di glicemia che possono essere interpretati con dei calcoli per stabilire diversi aspetti:
- la sensibilità insulinica (inverso della resistenza all’insulina) tramite il QUICKI index
- la resistenza insulinica e la funzionalità delle Beta-cellule tramite il modello HOMA-IR index
Il test dinamico per la valutazione dell’omeostasi glicemica è l’OGTT classico dove si valuta la risposta glicemica (talvolta anche insulinica) ad un carico orale di glucosio (75g), facendo prelievi ogni 30′ fino a 2 ore (metodo classico).
Insulina basale e glicemia

L’insulina basale è influenzata da numerosi fattori fisiologici, patologici e genetici. In una persona sana, la composizione della dieta in termini di macronutrienti può modificare i valori basali di insulina: alti carboidrati e dieta ipercalorica tendono ad aumentarne i valori, dieta ipocalorica e ipoglucidica o chetogenica a ridurne i valori.
Anche la massa grassa sottocutanea e specialmente viscerale ne influenza i valori normali, infatti maggiori livelli di insulina a digiuno sono tipici dell’insulino-resistenza e sindrome metabolica.
La glicemia in presenza di iperinsulinemia da insulinoresistenza può essere alterata o normale, in questo ultimo caso si è nelle fasi iniziali in cui il pancreas compensa la resistenza periferica al metabolismo glucidico aumentando la secrezione insulinica, tuttavia la situazione se non compensata con dieta, attività fisica ed eventuali farmaci tenderà alla comparsa del diabete (glicemia >126mg/dl o 200mg/dl dopo OGTT).
Insulina alta o insulina bassa: cause
L’insulina risulta bassa nelle fasi iniziali dell’esordio del diabete di tipo 1 o insufficiente in altri tipi di diabete come i MODY (diabete monogenico dell’età adulta), nella pancreasectomia, pancreatite cronica o negli stadi finali del diabete di tipo 2.
Certi regimi dietetici riducono l’insulina basale, come la dieta chetogenica e il digiuno come risultato della ridotta o nulla assunzione di carboidrati e dell’adattamento al metabolismo periferico dei chetoni.
L’insulina risulta invece elevata nel diabete di tipo 2 negli stadi iniziali, nella sindrome metabolica, insulino-resistenza, negli insulinomi (tumore delle cellule Beta), obesità, malattia o sindrome di Cushing (eccesso di cortisolo o glucocorticoidi), acromegalia (eccesso dell’ormone della crescita nell’adulto), mutazioni nel recettore dell’insulina.
Anche nel caso di diete ipercaloriche e iperglucidiche si elevano i livelli basali di insulina, come risposta all’evelata disoponibilità di carboidrati alimentari.
Come abbassare l’insulina
Il miglior modo per abbassare l’insulina, se elevata, è perdere grasso (se si è sovrappeso o obesi) e fare attività fisica di qualsiasi tipo.
Anche una dieta chetogena abbassa l’insulina, tuttavia peggiora l’affinità col glucosio perchè mette il corpo in condizioni di aumentare il metabolismo dei lipidi e dei chetoni a sfavore dei carboidrati e quindi del glucosio.
Da evidenze su studi controllati, a parità di calorie una dieta a “basso indice glicemico” sembra essere migliore nel migliorare i parametri dell’omeostasi glucidica (insulina, emoglobina glicata, lipidi ematici) in persone sovrappeso/obese con diabete di tipo 2, perchè si riduce la necessità di un picco più elevato di insulina per metabolizzare il glucosio, quindi si riduce il rischio di aumentare l’esposizione dei tessuti vascolari al glucosio e insulina in eccesso e si riduce la desensibilizzazione periferica all’insulina.
Certamente la dieta a basso IG ha un elevato contenuto di vegetali, fibre alimentari e cereali integrali che sono indipendentemente associati ad un miglioramento dello stato di salute, infatti sarebbe più corretto considerare l’alimentazione nel suo complesso che non isolando un singolo fattore al quale si attribuiscono tutti i meriti o demeriti della situazione (che sia esso l’IG, le proteine animali/vegetali o chissà cosa altro).
Per assurdo le patatine fritte, il fruttosio puro, i prodotti dolci da forno, le merendine, lo zucchero puro hanno un indice glicemico più basso delle carote o delle patate lesse.
Quindi sarebbero un’ottima scelta alimentare? Forse no…
Da notare che questi aspetti non hanno influito sulla perdita di peso, e che in una persona sana e attiva, sono decisamente poco rilevanti se presi in isolamento: cioè quanto sale il picco di glucosio in una persona sana in risposta ad un pasto non ha grande importanza, dato che nel resto del tempo la glicemia è normale a differenza del diabete dove è sempre elevata.
Conclusioni
L’insulina, per quanto in tempi recenti sia costantemente attaccata e accusata ingiustamente, ha un ruolo vitale nel corpo umano, sia la carenza che l’eccesso possono essere dannosi. Pensare che sia la causa dell’obesità, non solo è abbastanza limitativo, ma non è nemmeno conciliabile con l’evidenza scientifica e le leggi dell’universo, mentre possiamo invece riassumere le sue funzioni in questi punti:
- è considerato l’ormone anabolico per eccellenza (quando in realtà ha in primis una funzione anticatabolica)
- aumenta l’utilizzo del glucosio e riduce quello degli acidi grassi
- è un ormone ipoglicemizzante e anoressizzante (in chi non ha una resistenza insulinica a livello ipotalamico)
- aumenta la sintesi di glicogeno, trigliceridi, colesterolo e proteine
- nel diabete di tipo 1 è ridotta o assente, viceversa nel diabete di tipo 2
- i suoi livelli sono determinati da genetica, adiposità, dieta e stile di vita
- in condizioni fisiologiche non stimola la sintesi proteica muscolare, ma riduce la proteolisi
Se ti interessa l’argomento dieta, dimagrimento e ricomposizione corporea, scarica la nostra guida gratuita per cominciare:

Guida di base alla nutrizione
Come mangiare correttamente per dimagrire
Bibliografia essenziale
- Garndner & Shoback, Greenspan’s endocrinologia generale e clinica, Piccin 2009
- Nelson & Cox, I Prinicipi di biochimica di Lehninger, Zanichelli 2014
- Liguri, Nutrizione e dietologia, Zanichelli 2015
- Project Diet vol.1 e 2, D. Esposito
- https://emedicine.medscape.com
- Trommelen, J., Groen, B., Hamer, H., de Groot, L., & van Loon, L. (2015). MECHANISMS IN ENDOCRINOLOGY: Exogenous insulin does not increase muscle protein synthesis rate when administered systemically: a systematic review, European Journal of Endocrinology, 173(1), R25-R34.
- Dimitriadis, George & Mitrou, Panayota & Lambadiari, Vaia & Maratou, Eirini & A Raptis, Sotirios. (2011). Insulin effects in muscle and adipose tissue. Diabetes research and clinical practice. 93 Suppl 1. S52-9. 10.1016/S0168-8227(11)70014-6.
- McCulloch, L.J., Bunt, M.V., Braun, S., Frayn, K.N., Clark, A.W., & Gloyn, A.L. (2011). GLUT2 (SLC2A2) is not the principal glucose transporter in human pancreatic beta cells: implications for understanding genetic association signals at this locus. Molecular genetics and metabolism, 104 4, 648-53 .
- Gardner CD, Trepanowski JF, Del Gobbo LC, et al. Effect of Low-Fat vs Low-Carbohydrate Diet on 12-Month Weight Loss in Overweight Adults and the Association With Genotype Pattern or Insulin Secretion: The DIETFITS Randomized Clinical Trial [published correction appears in JAMA. 2018 Apr 3;319(13):1386] [published correction appears in JAMA. 2018 Apr 24;319(16):1728]. JAMA. 2018;319(7):667–679. doi:10.1001/jama.2018.0245
- Hall KD, Bemis T, Brychta R, et al. Calorie for Calorie, Dietary Fat Restriction Results in More Body Fat Loss than Carbohydrate Restriction in People with Obesity. Cell Metab. 2015;22(3):427–436. doi:10.1016/j.cmet.2015.07.021
- Hall KD, Guyenet SJ, Leibel RL. The Carbohydrate-Insulin Model of Obesity Is Difficult to Reconcile With Current Evidence. JAMA Intern Med. 2018;178(8):1103–1105. doi:10.1001/jamainternmed.2018.2920
- Fujita S, Rasmussen BB, Cadenas JG, Grady JJ, Volpi E. Effect of insulin on human skeletal muscle protein synthesis is modulated by insulin-induced changes in muscle blood flow and amino acid availability. Am J Physiol Endocrinol Metab. 2006;291(4):E745–E754. doi:10.1152/ajpendo.00271.2005
- Cameron AR, Logie L, Patel K, et al. Metformin selectively targets redox control of complex I energy transduction. Redox Biol. 2017;14:187–197. doi:10.1016/j.redox.2017.08.018
- Duncan RE, Ahmadian M, Jaworski K, Sarkadi-Nagy E, Sul HS. Regulation of lipolysis in adipocytes. Annu Rev Nutr. 2007;27:79–101. doi:10.1146/annurev.nutr.27.061406.093734
- Liljenquist JE, Bomboy JD, Lewis SB, et al. Effects of glucagon on lipolysis and ketogenesis in normal and diabetic men. J Clin Invest. 1974;53(1):190–197. doi:10.1172/JCI107537
- Ojo O, Ojo OO, Adebowale F, Wang XH. The Effect of Dietary Glycaemic Index on Glycaemia in Patients with Type 2 Diabetes: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients. 2018;10(3):373. Published 2018 Mar 19. doi:10.3390/nu10030373
- Vega-López, S.; Venn, B.J.; Slavin, J.L. Relevance of the Glycemic Index and Glycemic Load for Body Weight, Diabetes, and Cardiovascular Disease. Nutrients 2018, 10, 1361.