Ormoni femminili: cosa conoscere sugli estrogeni

Tradizionalmente, per ormoni femminili si fa spesso riferimento agli estrogeni, che sono sicuramente rappresentativi della donna, ma non sono certo gli unici e fanno parte anche del sistema endocrino maschile, con ovvie differenze quantitative.
Tra gli estrogeni, il più importante è l’estradiolo (E2), poi sono presenti anche l’estriolo (E3) e l’estrone (E1) che sono meno attivi e più importanti nella menopausa.
Talvolta sono incolpati di essere la causa di eventuali ingrassamenti, aumenti di peso, sbalzi di umore etc… in realtà la loro funzione è molto più articolata.
Ormoni femminili: quali sono ?
L’estradiolo
Partiamo dal più conosciuto, l’estradiolo o 17-beta estradiolo, la sua produzione aumenta in modo importante durante la fase follicolare e si riduce nella fase luteale.
Viene prodotto per aromatizzazione del testosterone, ormone tipicamente associato all’uomo, ma fondamentale anche nella donna.
La maggior parte dell’estradiolo nella donna in età fertile è prodotto dalle cellule della granulosa a livello follicolare sotto stimolo dell’FSH (ormone follicolo stimolante), mentre in menopausa l’estradiolo è prodotto in quantità notevolmente inferiori e deriva dall’aromatizzazione degli androgeni prodotti a livello del surrene.
Apriamo una piccola parentesi sulle modificazioni ormonali del ciclo, che meriterebbero una trattazione molto più ampia :
in genere con la menopausa si assite ad un peggioramento della composizione corporea associato al notevole calo degli ormoni ovarici, tra cui l’estradiolo; paradossalmente l’uso di anticoncezionali ormonali è aneddoticamente associato anche esso al peggioramento della composizione corporea.
In letteratura gli effetti sono in media neutri (anche se la maggior parte degli studi hanno preso in esame il peso e non la composizione corporea) ma con enorme variabilità tra donne, si sono osservate perdite fino a 16kg e aumenti fino a 36kg in 12 mesi!
Gli anticoncezionali (in particolare orali, cerotti, iniezioni, pellets) inoltre riducono la sintesi di testosterone fino al 50%, che è già ridotto nella donna; questo non gioca a favore della composizione corporea (massa muscolare, forza) e di alcuni aspetti psicologici (libido).
Tornando all’estradiolo, vediamo che ha diversi effetti in molti tessuti e organi:
- riduce l’attività delle LPL degli adipociti, riducendo l’uptake di acidi grassi nell’adipocita
- aumenta la sensbilità dei recettori Alfa-2 adrenergici, inibendo la lipolisi mediata dalle catecolammine
- aumenta la sintesi del collagene in tutti i tessuti, contribuisce quindi sia al rimodellamento di tendini e legamenti che alla formazione della cellulite
- riduzione dell’attività della tiroide
- aumento della leptina e della sua sensibilità (riduzione della fame)
- aumento del consumo di acidi grassi nel muscolo durante l’esercizio (mediato da LPL muscolare e AMPK)
- riduzione del catabolismo delle HDL e della sintesi delle LDL (effetto positivo sulla salute cardiovascolare)
- riducono la risposta infiammatoria e i ROS, stimolano la sintesi proteica muscolare e riducono la resistenza dei tendini
- aumento della sensbilità all’insulina, risparmio di glucosio epatico e sintesi di glicogeno
- aumento della sintesi nel SNC di serotonina e dopamina
- stimolano la maturazione del follicolo e la prolifrazione dell’endometrio
- effetto trofico sulla ghiandola mammaria
- completamento dell’ossificazione con chiusura delle epifisi (motivo per il quale le ragazze crescono e si sviluppano prima, ma sono in media più basse)
- sviluppo e mantenimeto dei caratteri sessuali femminili secondari (ghiandole mammarie, distribuzione del tessuto adiposo, allargamento del bacino, sviluppo dei genitali etc…)
Gli estrogeni quindi non fanno ingrassare senza ritegno, anzi, hanno un effetto tendenzialmente positivo in questo senso perchè l’estradiolo migliora la sensbilità insulinica, riduce la fame, induce sensazione di benessere psicologico, riduce la sintesi di trigliceridi sia nel fegato che nel tessuto adiposo. Tuttavia riduce anche la lipolisi nel grasso più ostinato (ricco di recettori Alfa-2), che caratterizza il fenotipo ginoide o tipicamente femminile, cioè nel complesso riduce il turnover lipidico rendendo più lento il dimagrimento nella donna rispetto all’uomo.
Il progesterone
Il secondo ormone femminile più conosciuto è il progesterone, la cui produzione aumenta nella fase luteinica sotto stimolo dei picchi di LH indotti dall’estradiolo; il follicolo scoppia e diventa corpo luteo, rilasciando l’ovocita.
Chimicamente è più simile agli ormoni androgeni e steroidi surrenalici, infatti ne condivide l’affinità con i loro recettori, con un effetto però di antagonismo, andando quindi a ridurne la segnalazione cellulare.
Il progesterone tipicamente si alza dopo il crollo dei livelli di estradiolo indotto dallo scoppio del follicolo e causa importanti cambiamenti fisiologici, che nel complesso si oppongono alle azioni degli estrogeni, infatti:
- antagonizza gli estrogeni che già sono ridotti, inducendo aumento dell’uptake di acidi grassi nel tessuto adiposo, tramite la LPL e la ASP
- induce insulino-resistenza e rende più instabili le glicemie
- riduce la leptina e la sintesi di serotonina e dopamina, spingendo all’iperfagia in particolare di cibi molto calorici e palatabili (tra cui la cioccolata, che sembra avere un ruolo particolare) e a sbalzi d’umore
- aumento del dispendio energetico a riposo, fino a 100-300 kcal, che tuttavia sono facilmente compensabili dall’aumento della fame
- riduce gli effetti positivi degli estrogeni e androgeni sul muscolo scheletrico, riducendo la sintesi proteica
- aumenta ulteriormente l’utilizzo di grassi a scopo energetico a scapito del glucosio anche durante l’attività fisica
- riduce la ritenzione idrica indotta dagli estrogeni
Il progesterone quindi ha effetti opposti sul metabolismo e la composizione corporea, nonostante aumenti il dispendio energetico.
La prolattina
La prolattina è il terzo ormone femminile che andiamo a vedere, è tipicamente associata alla donna è presente anche nell’uomo, con ruoli diversi. Viene prodotta dall’ipofisi, specialmente quando si abbassano i livelli di dopamina (fase luteale). La sua sintesi nell’ipofisi è mediata dalle cellule lattotrope, che vengono stimolate dagli estrogeni, mentre nell’endometrio è prodotta a seguito dello stimolo del progesterone.
La sua secrezione non aumenta finchè è inibita dalla dopamina, solo successivamente aumenta la secrezione con la riduzione dei livelli di dopamina ed è responsabile dello sviluppo dei dotti delle ghiandole mammarie durante la gravidanza e l’allattamento, stimolando anche la produzione di latte.
Nella fase pre-mestruale sembra essere responsabile dei dolori o sensazione di fastidio/tensione alle ghiandole mammarie, dovuta alla sua azione stimolante.
Ha numerose altre funzioni, diverse ancora sconosciute ma sembra essere un modulatore della risposta neuroendocrina allo stress (vedi cortisolo), influenzando la neurogenesi, l’attività del sistema immunitario e la secrezione di gonadotropine.
Ciclo mestruale e alterazioni psicofisiche
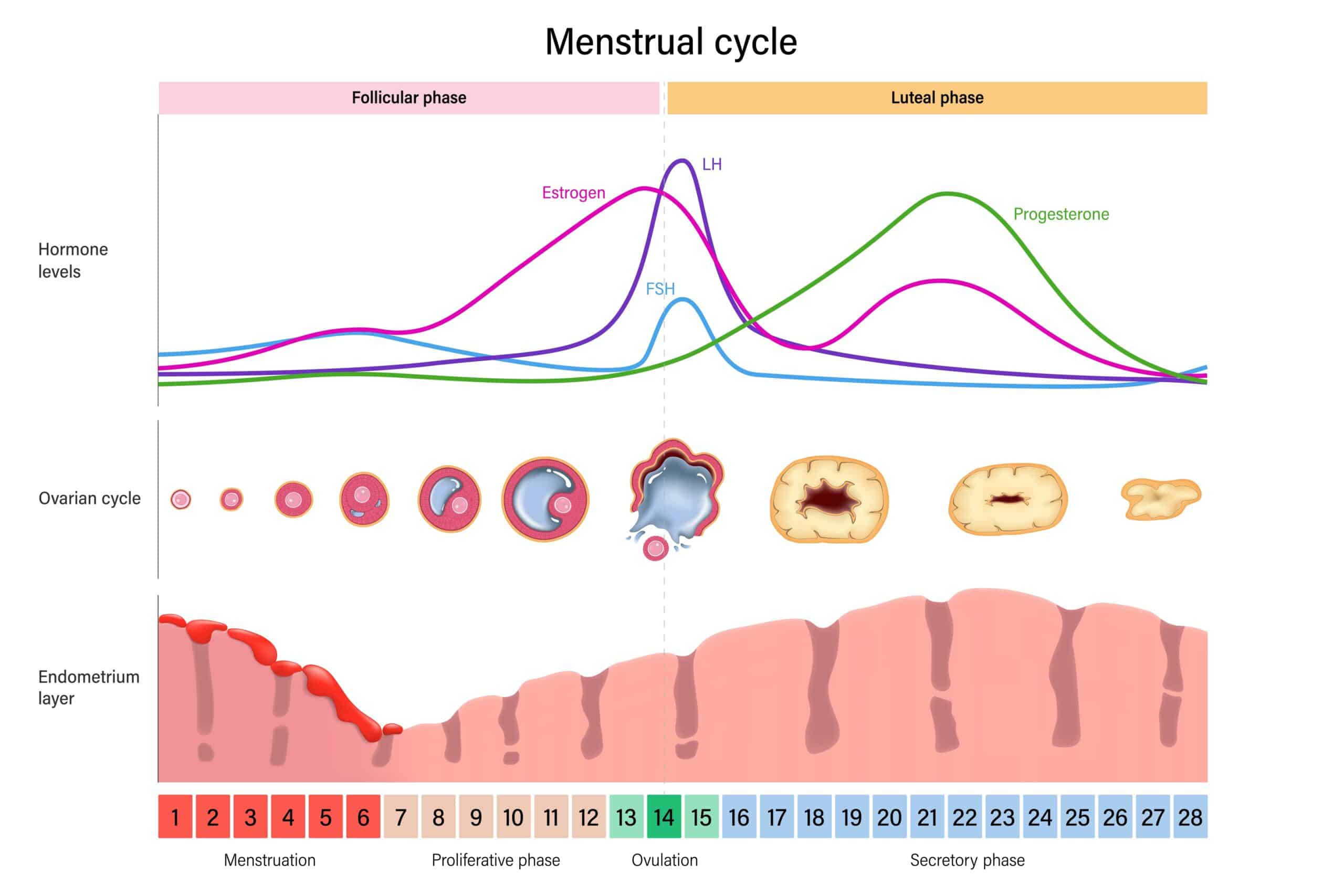
Per convenzione, si definisce ciclo mestruale il periodo di 28 giorni tra due perdite mestruali, che in realtà possono fisiologicamente variare in lunghezza di alcuni giorni (24-32). La perdita di sangue è dovuta allo sfaldamento dell’endometrio douto al crollo ormonale (se non c’è stata fecondazione dell’ovocita) e all’ischemia dei vasi formatisi precedentemente.
Nelle prime 2 settimane, si ha la fase follicolare caratterizzata dai primi giorni di mestruazioni (in genere 3-5 giorni) seguita dalla fase secretiva dove si ha progressivo aumento dell’estradiolo secreto dai follicoli (sotto stimolo dell’LH), che maturano sotto stimolo dell’FSH. Il progesterone rimane basso, lasciando la dominanza agli estrogeni che stimolano la proliferazione dell’endometrio.
Quando gli estrogeni raggiungono livelli consistentemente elevati, creano un feedback positivo nei confronti dell’LH che aumenta di pulsatilità, causando lo scoppio del follicolo dominante (più follicoli sono reclutati, ma solo quello che esprime più recettori per l’FSH matura completamente) e la fuoriuscita dell’ovocita (ovulazione) che viene “catturato” da una delle tube di Fallopio.
I follicoli secondari vanno incontro a processi involutivi, mentre il follicolo dominante si trasforma in corpo luteo, che segna l’inizio della fase luteinica o secretiva (seconda metà del mese), con forte diminuizione degli estrogeni e un progressivo innalzamento del progesterone. Se non vi è fecondazione dell’ovocita, il corpo luteo continua la secrezione di progesterone che raggiunge il picco circa attorno alla terza settimana, per poi regredire.
Dalla terza alla quarta settimana si ha la fase luteale tardiva, caratterizzata da riduzione delle gonadotropine, estrogeni e progesterone.
Spesso in questa fase si presenta la sindrome pre-mestruale, caratterizzata da numerosi sintomi poco piacevoli quali crampi (che preparano allo sfaldamento dell’endometrio), sbalzi d’umore, craving di dolci e cioccolata, anedonia, sindromi ansioso-depressive che possono essere in alcune donne (5-10%) piuttosto gravi, con comparsa della disforia pre-mestruale, inserito nel DSM-5 come disturbo psichiatrico; scarsa energia psicofisica e altri sintomi soggettivi.
La riduzione del progesterone, aumenta anche l’azione residua degli androgeni che può causare acne, irritabilità e aumento della ritenzione idrica, specialmente con un’alimentazione blianciata e ricca in sodio.
Sulla cioccolata ci sono interessanti studi e teorie, perchè tra i dolci è il cibo più ricercato nella sindrome pre-mestruale. Il cacao contiene numerose sostanze psicoattive e neurotrasmettitori come dopamina, serotonina, tiramina, così come sostanze stimolanti, dopaminergiche e acidi grassi analoghi dei cannabinoidi endogeni, coinvolti nella modulazione del dolore. Anche il contenuto di magnesio è importante, la sua supplementazione indipendemente dalla cioccolata sembra infatti ridurre i sintomi. Ovviamente la cioccolata è anche una combinazione di grassi + zuccheri, che stimolano il rilascio di dopamina nello striato provocando piacere.
| Fase del ciclo | LH (UI/L) | FSH (UI/L) | E2 (pg/ml) | Progesterone (ng/ml) |
| F. Follicolare | 2,4 – 12,6 | 3,5 – 12,5 | 12,4 – 233 | 0,0 – 1,4 |
| F. Ovulatoria | 14 – 95,6 | 4,7 – 21,5 | 41 – 398 | 3,3 -25,6 |
| F. Luteinica | 1 – 11,4 | 1,7 – 7,7 | 22,3 – 341 | 4,4 – 28 |
| Post Menopausa | 7,7 – 58,5 | 25,8 – 134,8 | 0,0 – 138 | 0,0 – 0,7 |
Alterazioni del normale ciclo mestruale
Le più comuni cause di alterazioni patologiche del ciclo mestruale in età fertile sono l’amenorrea funzionale ipotalamica (FHA) tipica di atlete e anoressiche, e la sindrome dell’ovaio policistico (PCOS).
La prima (FHA) è caratterizzata dall’assenza del ciclo mestruale, in quanto l’insufficienza introito energetico assime all’aumentata attività fisica causano forte deplezione del tessuto adiposo a livelli patologici per la donna. La carenza di Leptina, inibisce la secrezione delle gonadotropine, impedendo quindi la normale funzione dell’ovaio.
Questa situazione se troppo protratta nel tempo può portare a futuri problemi di fertilità e alla comparsa della famosa triade dell’atleta donna: amenorrea/oligomenorrea, osteopenia/osteoporosi, insufficienza introito energetico e calo ponderale.
La situazione è molto seria, ma è spesso recuperabile col recupero della massa grassa fisiologica, anche se talvolta è necessaria una “induzione” con estro-progestinici.
La PCOS invece è molto più complessa, la sua eziologia non è chiara ma intervengono sia fattori genetici che nutrizionali.
La caratteristica clinica è una situazione di amenorrea o oligomenorrea indotta da iperandrogenismo (fino a 2-3 volte i valori normali nella donna) e carenza di estrogeni, che impediscono la completa maturazione dei follicoli che rimangono “bloccati” senza far fuoriuscire l’ovocita.
Questa è una frequente causa di infertilità femminile (fino al 20%), è spesso associata a sovrappeso, obesità, insulino-resistenza e diabete mellito di tipo 2, comorbidità psichiatriche quali depressione e sindromi ansiose.
Lo stato di iperandrogenismo è indotto dall’insulinoresistenza, condizione che a sua volta induce iperandrogenismo:
- L’insulina riduce le SHBG, aumentando gli androgeni liberi come il testosterone
- Il testosterone elevato nella donna favorisce la deposizione di grasso viscerale, aumentando l’infiammazione sistemica e l’insulino-resistenza
- L’insulina stimola preferenzialmente la biosintesi surrenale di androgeni
- Gli androgeni agiscono a feedback negativo sulle gonadotropine, in particolare sull’FSH che rimane troppo basso per far maturare il follicolo e aromatizzare gli androgeni prodotti dalle cellule della teca, aumentano invece la pulsatilità dell’LH che stimola la sintesi di androgeni
L’iperandrogenismo causa inoltre la comparsa di caratteri sessuali tipicamente maschili, come l’aumento dei peli, la diversa distribuzione del grasso sottocutaneo, la comparsa di acne, l’alopecia androgenetica, andando a peggiorare la qualità di vita della donna affetta.
Dal punto di vista nutrizionale, la perdita di peso è molto efficace nel ridurre i sintomi e migliorare il quadro clinico della malattia, anche una modesta perdita di peso è di grande aiuto. Le terapie farmacologiche sono spesso necessarie, possono essere ormonali come l’uso di estro-progestinici per aumentare i livelli di estrogeni e ridurre gli androgeni oppure l’uso di farmaci per la fertilità come il clomifene citrato che aumenta la secrezione di FSH, così come antidiabetici orali (Metformina) che migliorano la sensibilità all’insulina e aumentano le SHBG riducendo gli androgeni liberi.
Vi è anche un integratore molto efficace in questo caso che è l’inositolo e il D-Chiro inositolo, che agisce aumentando la sensibilità insulinica.
Indipendentemente dalla PCOS, l’iperandrogenismo è un tratto positivo nelle atlete, avere livelli più elevati di androgeni migliora le prestazioni fisiche, la massa muscolare e la forza; negli ultimi anni è infatti molto dibattuto questo aspetto negli sport olimpici, tanto che ha portato recentemente al bandimento dalla categoria femminile da parte della IAAF, di una mezzofondista sudafricana con naturali alti livelli di testosterone, fuori dai range per una donna (Caster Semenya).
Menopausa ed ormoni femminili
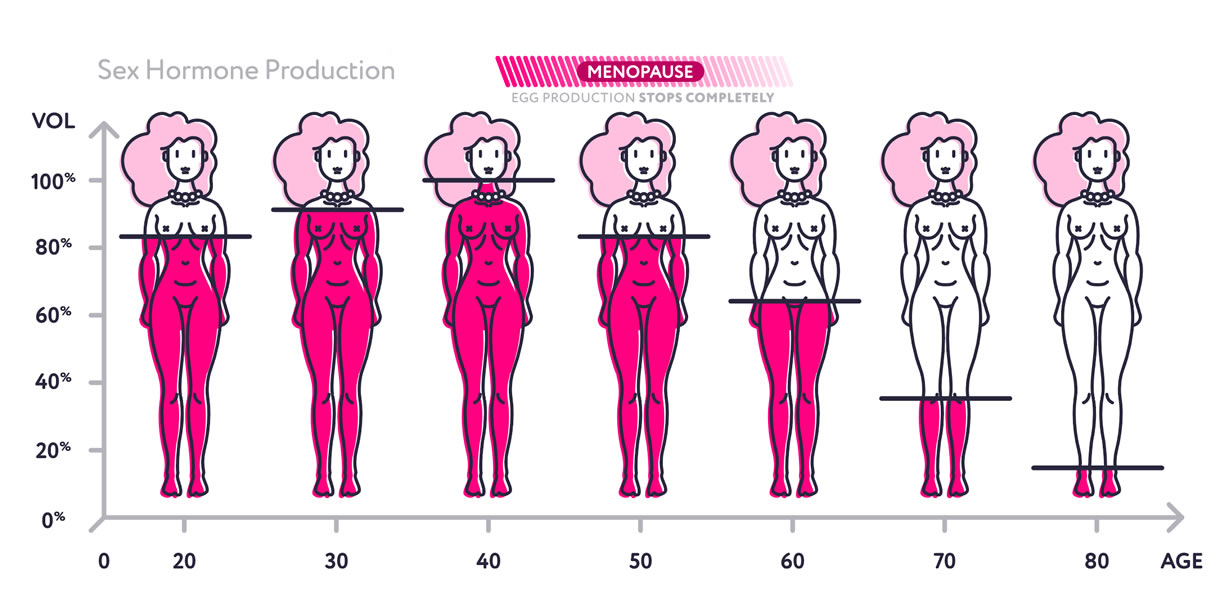
L’assenza per 12 mesi del ciclo segna l’inizio della menopausa, caratterizzata dall’esaurimento di follicoli da far sviluppare e quindi cessazione dell’età fertile, avviene in genere attorno i 50 anni.
Si ha una riduzione importante degli ormoni femminili, con un relativo sbilancio nei confronti degli androgeni che vengono prodotti dal surrene.
La carenza di estrogeni si porta dietro conseguenze psico-fisiche negative, in parte attenuabili con l’alimentazione in parte non attenuabili se non con terapia ormonale sostitutiva (HRT), che non è esente da rischi, specialmente se portatrici di oncogeni mutati (BRCA). La HRT è indicata per la terapia a breve termine dei sintomi della menopausa, sintomi vasomotori, vampate di calore e prevenzione dell’osteoporosi.
L’effetto trofico degli estrogeni sull’osso è almeno in parte sostituibile con fitoestrogeni, cioè estrogeni deboli naturali, spesso derivanti da soia (sono sufficienti 30g di proteine isolate di soia al giorno) che hanno azione agonista sull’osso ma non su altri tessuti, risultano infatti probabilmente protettivi nei confronti del cancro al seno. Anche la supplementazione di vitamina D3 è spesso necessaria, assieme ad un adeguato apporto di Calcio (1200mg).
I fitoestrogeni non sono abbastanza forti da agire a livello del sistema nervoso, sono quindi inefficaci sulla sfera psicologica.
Per il trofismo del sistema muscolo scheletrico, valgono le stesse raccomandazioni dell’uomo, indipendentemente dallo stato ormonale: sufficiente apporto proteico di qualità, rapportato anche con l’attività fisica e l’attività fisica stessa; che serve anche a prevenire il peggioramento della composizione corporea (accumulo di grasso addominale).
La terapia ormonale sostitutiva, così come i contracettivi ormonali combinati aumentano il rischio di cancro al seno (specialmente se c’è storia familiare e genetica sfavorevole), tumori benigni del fegato (gli steroidi orali hanno tutti una variabile epatotossicità) e riducono i rischi di cancro all’endometrio e ovaio. Sono quindi tutte scelte da discutere e valutare coscientemente col proprio medico specialsita per valutare il rapporto rischi/benefici.
In Europa esiste anche un farmaco poco usato che ha effetti misti estrogenici, progestinici e androgenici selettivi, il Tibolone. Studiato apposta per la sintomatologia della menopausa e l’endometriosi, non ha effetti sulle ghiandole mammarie, fegato e utero mentre conserva la sua attività su ossa, sistema nervoso e genitali esterni.
Conclusioni sugli ormoni femminili
Nonostante vi sia nell’idea comune una grossa differenza tra ormoni maschili e femminili, in realtà si tratta di stessi ormoni con rapporti molto diversi tra loro, ma ognuno ha la sua precisa funzione e le loro quantità diverse hanno infatti funzioni fisiologiche ben definite a seconda del sesso biologico dell’individuo. Riassumendo:
- L’estradiolo ha effetti metabolici nel complesso positivi, opposti al progesterone
- Il ciclo mestruale è caratterizzato da profonde modificazioni ormonali che condizionano l’aspetto metabolico, psicologico e nutrizionale della donna
- tutti gli ormoni sono importanti, una loro alterazione in eccesso o in difetto può danneggiare la salute psicofisica
- l’amenorrea funzionale non è una condizione fisiologica e sana
- nella PCOS si ha una complessa situazione caratterizzata da squilibrio tra androgeni ed estrogeni, insulinoresistenza con compromissione della feritilità e della salute psicofisica
- gli ormoni esogeni alterano la normale fisiologia con vantaggi e svantaggi, da valutare coscientemente
- la cioccolata è una droga 🙂
Bibliografia essenziale
- Lyle McDonald, The Women’s Book: A Guide to Nutrition, Fat Loss, and Muscle Gain, 2017
- Greenspan’s endocrinologia generale e clinica, Gardner & Shoback, Piccin 2009
- Gallo MF, Lopez LM, Grimes DA, Carayon F, Schulz KF, Helmerhorst FM. Combination contraceptives: effects on weight. Cochrane Database of Systematic Reviews 2014, Issue 1. Art. No.: CD003987AIRC – pillola anticoncezionale e cancro
- Leblanc, D.R. & Schneider, Magdalena & Angele, P & Volmer, G & Docheva, Denitsa. (2017). The Effect of Estrogen on Tendon and Ligament Metabolism and Function. The Journal of Steroid Biochemistry and Molecular Biology. 172. 10.1016/j.jsbmb.2017.06.008.
- KRISTEN BRUINSMA, DOUGLAS L. TAREN, Chocolate: Food or Drug?, Journal of the American Dietetic Association, Volume 99, Issue 10, 1999, Pages 1249-1256, ISSN 0002-8223,
- NICE guidelines – Menopause: diagnosis and management
- US Preventive Services Task Force. Hormone Therapy for the Primary Prevention of Chronic Conditions in Postmenopausal Women: US Preventive Services Task Force Recommendation Statement. JAMA.2017;318(22):2224–2233.
- Pramfalk C, Pavlides M, Banerjee R, et al. Sex-Specific Differences in Hepatic Fat Oxidation and Synthesis May Explain the Higher Propensity for NAFLD in Men. J Clin Endocrinol Metab. 2015;100(12):4425–4433