Metabolismo degli aminoacidi

Il metabolismo degli amminoacidi è l’insieme di reazioni che permette di estrarre e utilizzare l’energia proveniente dalle proteine e dagli amminoacidi per vari scopi.
Il metabolismo degli amminoacidi consiste di tre eventi principali:
- la digestione delle proteine che avviene nello stomaco e nell’intestino tenue, ad opera di diversi enzimi;
- le razioni cellulari che degradano le proteine o gli amminoacidi (catabolismo);
- le reazioni cellulari che sintetizzano amminoacidi o proteine (anabolismo).
Metabolismo degli aminoacidi
Prima di parlare di amminoacidi, è necessario spiegare il viaggio che intraprendono le proteine che assumiamo con la dieta.
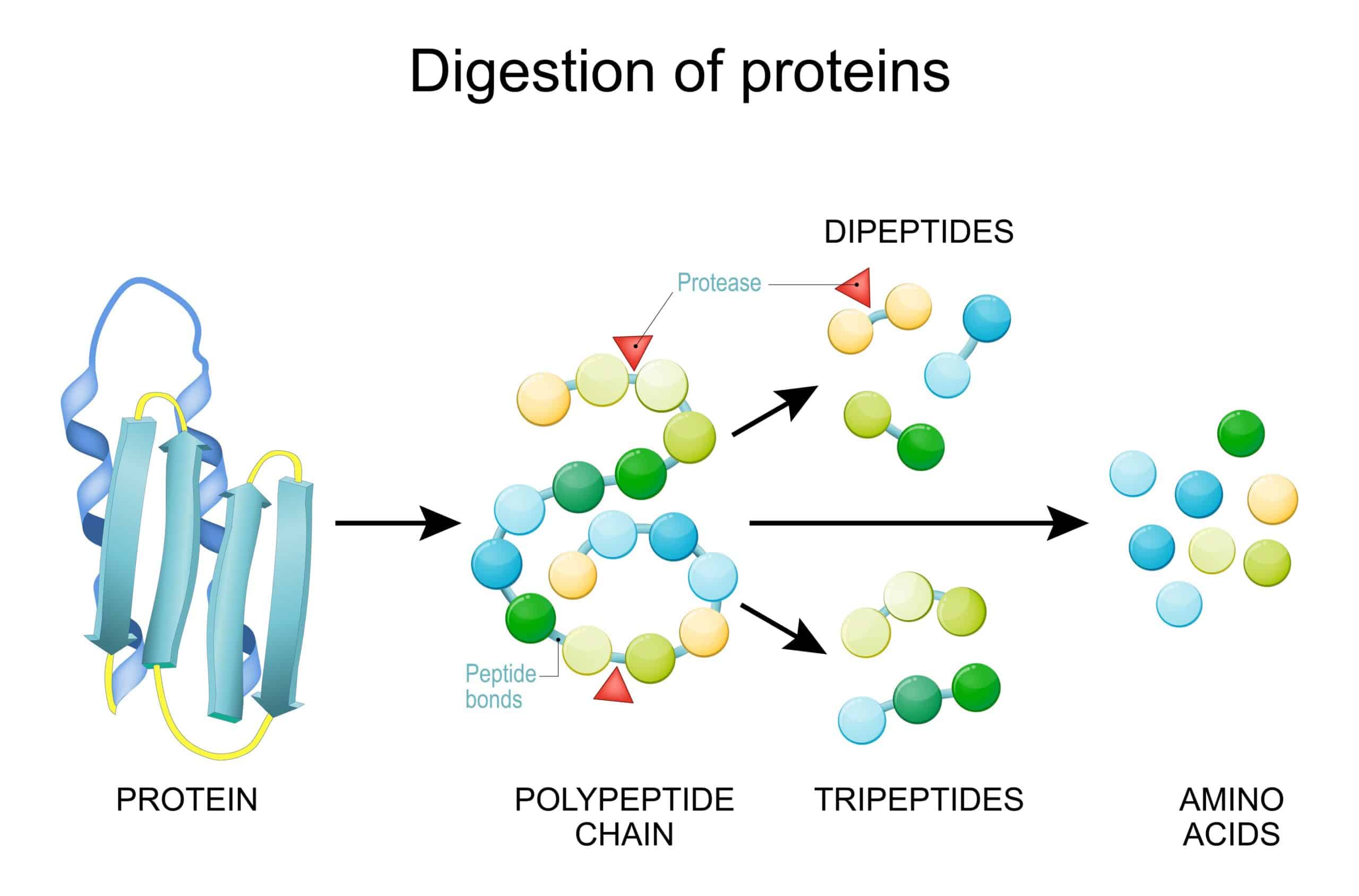
La digestione delle proteine inizia nello stomaco grazie all’azione dell’acido cloridrico (HCl) e della pepsina.
Il succo gastrico acido (pH 1-2,5) ha azione denaturante, ovvero rende le proteine più facilmente digeribili. La pepsina inizia la digestione delle proteine, scindendole in peptidi; la digestione gastrica non è mai completa per cui alcune proteine non vengono digerite a questo livello.
Le proteine non digerite e i peptidi giungono nell’intestino tenue, dove vengono attaccati da enzimi pancreatici (tripsina, chimotripsina e carbossipeptidasi A e B, elastasi) che formano amminoacidi liberi, di-tri peptidi e oligopeptidi (fino a 6 amminoacidi). Gli oligopeptidi e i peptidi vengono ulteriormente idrolizzati da oligopeptidasi e amminopeptidasi, enzimi presenti sull’orletto a spazzola degli enterociti.
I prodotti finali sono amminoacidi singoli e di-tripeptidi che attraversano la mucosa intestinale grazie a specifici trasportatori per passare poi in circolo e giungere al fegato, dove verranno metabolizzati.
Nota bene: a livello intestinale giungono anche oligopeptidi e proteine di origine esogena e endogena non digeriti. Queste molecole possono entrare direttamente negli enterociti attraverso la membrana o tramite endocitosi; quest’ultimo meccanismo è molto sviluppato nel neonato per assorbire le proteine del latte.
Le proteine esogene non possono essere immagazzinate nel nostro organismo, per cui gli amminoacidi assorbiti hanno due destini:
- vengono utilizzati per la biosintesi di proteine endogene e altri composti azotati;
- vengono degradati per formare energia.
Inoltre, tutte le proteine dell’organismo vengono continuamente degradate e sostituite, processo noto come turnover proteico; ogni giorno vengono degradate circa 250-300 g di proteine.
L’organismo ha a disposizione un “pool” di amminoacidi in cui confluiscono quelli provenienti dalla digestione e dalla degradazione delle proteine endogene; da questo insieme attinge il nostro corpo per formare nuove proteine.
Insomma, proteine e amminoacidi vengono continuamente riciclati.
Catabolismo aminoacidi
Il catabolismo degli amminoacidi di norma è responsabile solamente del 10-15% di energia totale necessaria all’uomo.
Gli amminoacidi vengono degradati in tre circostanze:
- durante il turnover proteico;
- quando gli amminoacidi esogeni sono in eccesso rispetto al fabbisogno per la sintesi proteica (dieta iperproteica);
- durante il digiuno (e il diabete mellito non controllato).
Le vie cataboliche principali sono le seguenti:
- la transamminazione toglie il gruppo amminico e lo trasferisce ad un altro amminoacido;
- la deamminazione toglie il gruppo amminico, formando ammoniaca;
- la decarbossilazione toglie una molecola di anidride carbonica, formando un’ammina biogena.
Ciclo dell’urea
I gruppi amminici, se non vengono riutilizzati per la sintesi di nuovi amminoacidi o altri composti azotati, vengono convertiti in un unico prodotto finale di escrezione.
L’ammoniaca è tossica per l’organismo e infatti è presente in tracce nel sangue poiché viene incorporata (in termini tecnici “organicata”) in composti organici non tossici (glutammato, glutammina e alanina) che hanno il compio di trasportarla al fegato per essere metabolizzata e rimossa.
In questo organo infatti avviene il ciclo dell’urea, una via metabolica che converte l’ammoniaca in urea; quest’ultima passa poi nel sangue e raggiunge i reni, dove viene escreta con le urine.
Il ciclo dell’urea è un processo molto dispendioso: circa il 15% dell’energia ricavata dalla demolizione degli amminoacidi è spesa per la sintesi dell’urea.
Inoltre, una quantità non molto rilevante, ma costante, di azoto è eliminata con le urine sotto forma di creatinina, il cui ammontare dipende dall’entità delle masse muscolari.
Sintesi aminoacidi
Tutti gli amminoacidi derivano da intermedi delle seguenti vie metaboliche:
L’azoto entra nelle vie di biosintesi come glutammato o glutammina.
I diversi organismi possiedono vie diverse per la sintesi dei venti amminoacidi comuni. Mentre la maggioranza dei batteri e le piante possono sintetizzarli tutti e venti, i mammiferi possono sintetizzarne solo una decina (amminoacidi non essenziali).
I rimanenti, gli amminoacidi essenziali, devono essere assunti con la dieta e sono:
- arginina (solo durante l’infanzia);
- fenilalanina;
- isoleucina;
- istidina
- leucina;
- lisina;
- metionina;
- treonina;
- triptofano;
- valina.
Per ricordarteli a memoria ti do questo consiglio: osserva le iniziali in ordine alfabetico: “FILMTV”. Dove guardi un FILM? In TV!
Come si ricava energia dagli aminoacidi?
I processi metabolici a carico degli amminoacidi convergono verso la formazione di prodotti in grado di entrare nel ciclo di Krebs.
In base al prodotto finale di degradazione possiamo distinguere tra:
- amminoacidi chetogenci, che vengono degradati ad acetil-CoA, convertito poi in corpi chetonici;
- amminoacidi glucogenici, che vengono degradati a piruvato o intermedi del ciclo di Krebs, convertiti poi in glucosio;
- amminoacidi misti, che possono formare sia glucosio, sia acetil-CoA.
Gli scheletri carboniosi sono quindi indirizzati alla chetogenesi o alla gluconeogenesi oppure sono completamente ossidati a CO2 e H2O tramite lo stesso ciclo dell’acido citrico.
Bibliografia
I principi di biochimica di Lehninger – Nelson e Cox
Le basi molecolari della nutrizione – Arienti
Alimentazione, Nutrizione e Salute – Debellis e Poli
Note sull’autore: Andrea Barone
Laureato magistrale in “Scienze dell’Alimentazione e Nutrizione Umana” (prossimo all’esame di stato per l’abilitazione all’esercizio della professione di biologo nutrizionista) e triennale in “Scienza della Nutrizione”. Attualmente è studente in Scienze Motorie.
Invictus Trainer che esercita da circa 4 anni l’attività di personal trainer, con l’obiettivo di migliorare la composizione corporea dei suoi clienti e correggere le loro abitudini alimentari. Aspira a crescere professionalmente nel settore sportivo agonistico in qualità di preparatore atletico e/o personal trainer curando parallelamente l’aspetto nutrizionale degli atleti.